| [предыдущий раздел] | [содержание] | [следующий раздел] |
1.7. Фугитивность (летучесть) и методы ее расчета
В работах по химической термодинамике для формального описания зависимости химического потенциала реального газа от давления пользуются методом Льюиса (1901), согласно которому вводится новая функция f, которая называется фугитивностью или летучестью и имеет размерность давления:
![]() (p, T) =
(p, T) = ![]() (T) + RT ln f(p, T).
(1.45)
(T) + RT ln f(p, T).
(1.45)
Выражение (1.45) аналогично зависимости химического потенциала идеального
газа от давления. Однако аналогия эта чисто формальна, поскольку фугитивность
является функцией давления и температуры, причем характер зависимости
f(p, T) индивидуален и зависит от природы газа.
Коэффициентом фугитивности ![]() называется безразмерная величина
называется безразмерная величина
![]() , причем
, причем ![]() (условие нормировки
фугитивности)
(условие нормировки
фугитивности)
Из уравнений (1.43) и (1.45) вытекает:
 (1.46)
(1.46)
или
 .
(1.47)
.
(1.47)
Используя определение фактора сжимаемости Z = pV/RT, уравнение (1.47) можно записать в виде:
 .
(1.48)
.
(1.48)
Используя уравнения (1.46) - (1.48), можно рассчитать фугитивность реальных газов графическими или аналитическими методами.
1.7.1. Графические методы
Графические методы используют для определения фугитивности чистого газа по экспериментальным данным об его объеме V при различных давлениях p и T = const.
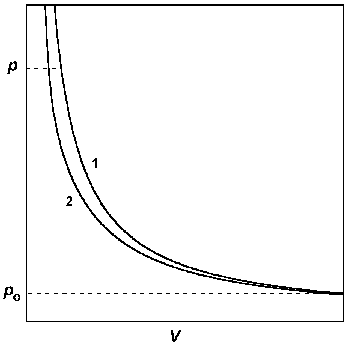
А) В координатах p - V строят изотермы идеального и реального газов от достаточно низкого давления, при котором эти изотермы практически сливаются, до давления, при котором требуется определить фугитивность. Интеграл в правой части уравнения (1.46) определяют графически (рис. 1.7).
 |
|
Рис.1.7. Графический метод определения фугитивности: построение р - V изотерм для идеального (1) и реального (2) газов. |
Б) Вычисляют объемную поправку реального газа ![]() , равную подынтегральному выражению в
уравнениях (1.46) и (1.47):
, равную подынтегральному выражению в
уравнениях (1.46) и (1.47):
![]() .
(1.49)
.
(1.49)
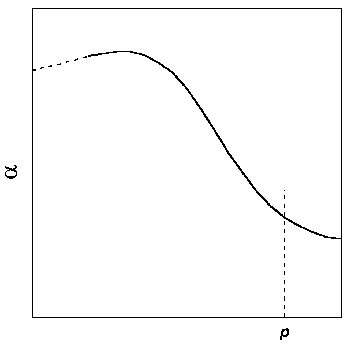
Затем строят зависимость ![]() от p при заданной температуре и интеграл в правой части
уравнения (1.47) определяют графически(рис. 1.8).
от p при заданной температуре и интеграл в правой части
уравнения (1.47) определяют графически(рис. 1.8).
 |
|
Рис.1.8. Графический метод определения фугитивности:
построение зависимости |
Преимущества метода Б) по сравнению с методом А) заключаются в следующем.
Во-первых, интервал изменения ![]() значительно меньше, чем V, особенно при высоких температурах.
Во-вторых, при p
значительно меньше, чем V, особенно при высоких температурах.
Во-вторых, при p ![]() 0,
0, ![]()
![]() const, поэтому зависимость
const, поэтому зависимость ![]() от p легко
экстраполировать на p = 0. При
от p легко
экстраполировать на p = 0. При ![]() = const уравнение (1.48)
приобретает вид
= const уравнение (1.48)
приобретает вид
![]() (1.50)
(1.50)
или
![]() (1.51)
(1.51)
При низких p экспоненту можно разложить в ряд, ограничившись двумя членами:
![]() ,
(1.52)
,
(1.52)
где pид - давление, которое имел бы идеальный газ, если бы он занимал тот же объем, что и реальный. С помощью уравнения (1.52) можно приближенно вычислять фугитивность при низких давлениях.
Смысл поправки ![]() при
p
при
p ![]() 0
наглядно проявляется при использовании вириального уравнения состояния. При
низких давлениях в уравнении (1.16) можно ограничиться членом со вторым
вириальным коэффициентом, т.е.
0
наглядно проявляется при использовании вириального уравнения состояния. При
низких давлениях в уравнении (1.16) можно ограничиться членом со вторым
вириальным коэффициентом, т.е.
pV = RT (1 + B2'p) (1.53)
или
![]() .
(1.54)
.
(1.54)
Таким образом, при p ![]() 0
поправка
0
поправка ![]() равна второму
вириальному коэффициенту со знаком "минус". [Отметим, что при любых конечных
значениях
равна второму
вириальному коэффициенту со знаком "минус". [Отметим, что при любых конечных
значениях ![]() в пределе
p
в пределе
p ![]() 0
получается уравнение состояния идеального газа, поскольку RT - pV
=
0
получается уравнение состояния идеального газа, поскольку RT - pV
= ![]() p, и,
следовательно,
p, и,
следовательно, ![]() ].
].
1.7.2. Аналитические методы
А). Аналитические методы основаны на подстановке в соотношение (1.47) уравнения состояния реального газа и аналитическом вычислении интеграла в правой части. Например, для газа Ван-дер-Ваальса после интегрирования получаем
![]() .
(1.55)
.
(1.55)
Точность расчета фугитивности будет определяться точностью используемого уравнения состояния в исследуемом интервале p и T.
Б). Фугитивность газа можно приближенно определить на основе закона
соответственных состояний (метод Ньютона). Согласно закону соответственных
состояний, коэффициент фугитивности ![]() является универсальной функцией
приведенных давления pr и температуры Tr.
Зависимость
является универсальной функцией
приведенных давления pr и температуры Tr.
Зависимость ![]() (
pr, Tr) представляют в виде обобщенных диаграмм
или уравнений, из которых легко определить коэффициент фугитивности
(
pr, Tr) представляют в виде обобщенных диаграмм
или уравнений, из которых легко определить коэффициент фугитивности ![]() (и фугитивность f =
(и фугитивность f =
![]() p), зная
критические параметры газа.
p), зная
критические параметры газа.
Задачи и упражнения к главе 1
* Задачи, помеченные звездочкой, рекомендуется решать с помощью компьютера, оснащенного программой графической обработки экспериментальных данных, например, Excel, Origin или SigmaPlot.
1.1. Выразите уравнение состояния Ван-дер-Ваальса в виде вириального разложения по степеням 1/Vm и получите выражения для вириальных коэффициентов B2 и B3 через параметры a и b. Воспользуйтесь разложением: 1/(1-x) = 1 + x + x2 + ...
1.2. Уравнения (1.15) и (1.16) являются разложениями по степеням 1/Vm и p, соответственно. Найдите соотношение между B2, B3 и B2', B3'.
1.3. Предложено следующее уравнение состояния:
![]() .
.
Покажите, что это уравнение приводит к критическому поведению. Выразите критические константы газа через параметры B и C и получите выражение для фактора сжимаемости в критической точке.
1.4. Покажите, что для газа с жесткими молекулами сферической формы при учете только парных взаимодействий константа b в уравнении Ван-дер-Ваальса равна учетверенному собственному мольному объему молекул. Оцените значение b для Ne, если его молекулярный диаметр равен 0.258 нм.
1.5.* Покажите, что второй вириальный коэффициент и молярную массу газа можно
получить, строя график p/![]() от p, где p - давление газа,
от p, где p - давление газа, ![]() - его плотность. Рассчитайте
B2 для диметилового эфира, пользуясь следующими данными:
- его плотность. Рассчитайте
B2 для диметилового эфира, пользуясь следующими данными:
| р,Торр | 91,74 | 188,98 | 277,3 | 452,8 | 639,3 | 760,0 |
| 0,232 | 0,489 | 0,733 | 1,25 | 1,87 | 2,30 |
1.6.* Рассчитайте второй вириальный коэффициент для водорода при 0o C, пользуясь следующими данными:
| р, бар | 50,7 | 101,3 | 202,6 | 303,9 |
| V,л/моль | 0,4634 | 0,2386 | 0,1271 | 0,090 |
1.7.* Пользуясь правилом прямолинейного диаметра [уравнение (1.2)], определите критический мольный объем CCl4, используя следующие данные:
| t,oC | 100 | 150 | 200 | 250 | 270 | 280 |
| 1,4343 | 1,321 | 1,1888 | 0,9980 | 0,8666 | 0,7634 | |
| 0,0103 | 0,0304 | 0,0742 | 0,1754 | 0,2710 | 0,3597 |
Критическая температура CCl4 равна 283,1 o C.
1.8. Найдите ![]() и
и ![]() для а) идеального газа, б)
для газа Ван-дер-Ваальса, в) для газа Дитеричи (табл. 1.4). Покажите, что
для а) идеального газа, б)
для газа Ван-дер-Ваальса, в) для газа Дитеричи (табл. 1.4). Покажите, что ![]() .
.
1.9. Выведите выражение для работы изотермического обратимого расширения газа, подчиняющегося уравнению состояния Ван-дер-Ваальса.
1.10. Выведите выражение для работы изотермического обратимого расширения газа, подчиняющегося вириальному уравнению состояния (1.15).
1.11. Второй и третий вириальные коэффициенты в уравнении (1.15) для аргона при 273 К равны соответственно В2 = - 21,7 см3/моль и В3 = 1200 см6/моль2. Рассчитайте: а) работу обратимого изотермического расширения при этой температуре, б) работу расширения против постоянного давления 1 атм и в) работу расширения в предположении, что аргон ведет себя идеально. Примите, что Vm,1 = 500 см3 и Vm,2 = 1000 см3.
1.12. Покажите, что работа изотермического обратимого расширения газа Ван-дер-Ваальса может быть выражена в виде приведенных переменных и что, определив приведенную работу как Ar = A3b/a, можно получить выражение, не зависящее от природы газа.
Литература к главе 1
1.М.П. Вукалович, И.И. Новиков